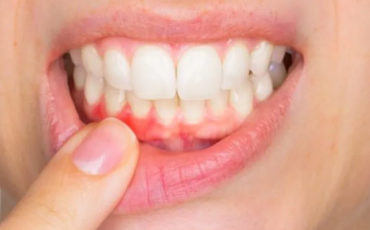
Les prostaglandines et le thromboxane ont divers rôles dans des conditions physiologiques et pathologiques comprenant l’inflammation, la fonction immunologique, l’ovulation, les maladie cardiovasculaire, et la genèse tumorale (1).
Les prostanoïdes contribuent aux signes et aux symptômes de l’inflammation aiguë et chronique qui comprenennt la douleur, la fièvre, le gonflement, et le vasodilatation. L’importance physiologique des prostanoïdes est accentuée par l’utilisation des anti-inflammatoires non-stéroïdiens qui bloquent la cyclooxygenase.
En réponse à divers stimuli, l’acide arachidonique libéré par des phospholipides de membrane est métabolisé en prostaglandines et en thromboxane par la cyclooxygenase. Au début des années 90, deux isoformes de cyclooxygenase, la cyclooxygenase-1 et la cyclooxygenase-2, ont été identifiés (2, 3).
Alors que la cyclooxygenase-1 est constitutivement exprimé dans beaucoup de tissus et qu’elle soutient la biosynthèse de prostaglandine exigée pour l’homéostasie de maintien d’organe et des tissus, la cyclooxygenase-2, quant à elle, est induite après stimulation par des molécules pro-inflammatoires comprenant l’interleukine-1, le facteur-α de nécrose tumorale, et les lipopolysaccharides et elle est régulée en amont pendant l’inflammation.
Les médicaments anti-inflammatoires non-stéroïdiennes traditionnelles telles que l’aspirine, le naproxene, et l’indométhacine empêchent les activités dépendant des cyclooxygenase-1 et cyclooxygenase-2 mais possèdent des effets secondaires défavorables qui incluent la toxicité gastro-intestinale.
Les inhibiteurs sélectifs de la cyclooxygenase-2 ont été développés dans l’espoir qu’ils induisent des effets secondaires mieux maitrisés moins défavorables ; certains d’entre eux ont été déjà employés pour le traitement clinique de la douleur lié à l’ostéoarthrite, au rhumatisme articulaire, et à la menstruation. En outre, l’analyse moléculaire et pharmacologique récente a démontré que les prostanoïdes exercent leurs actions biologiques par l’intermédiaire des récepteurs spécifiques des prostanoïdes sur des cellules cible, suggérant des mécanismes possibles complexe de leurs effets . Des organisations microbiennes dans la plaque dentaire sont considérées en tant que microbes pathogènes primaires de la maladie parodontale.
Cependant, la réponse immunitaire aux microbes pathogènes, qui induit la production des molécules inflammatoires comprenant des cytokines et des prostanoïdes, est impliquée dans le déclenchement et la progression de la maladie parodontale (4).
En 1974, Goodson et al. (7) a rapporté un taux 10 fois plus élevé de prostaglandine E2 sur de tissu gingival enflamé, en comparaison avec des tissu gingivaux sains.
D’autres chercheurs ont également démontré que des niveaux de prostaglandine E2 élevés sont observés dans les tissus parodontaux chez des patients avec une gingivite et une parodontite. Offenbacher à Al (16) a démontré que les niveaux de la prostaglandine E2 dans le fluide gingival créviculaire des patients qui présentaient des maladies parodontales sont sensiblement plus élevés que ceux dans les sujets parodontalement en bonne santé, et en outre cette concentration en prostaglandine E2 dans le fluide créviculaire gingival est efficace pour maîtriser la progression des parodontites, c.-à-d. la perte d’attachement, avec un degré élevé de sensibilité et de spécificité (0.76 et 0.96, respectivement). Roberts et al. ont prouvé qu’il y avait une corrélation significative entre les niveaux de la prostaglandine E2 dans le fluide créviculaire gingival et les niveaaux des perte d’os.
Les études précédentes ont démontré que les médicaments anti-inflammatoires non-stéroïdiens traditionnels comprenant l’indométhacine (11, 12, 13), le flurbiprofène (14, 15), l’ibuprofène (16), le naproxen (17, 18), l’acide méclofénamique (19), le piroxicam (20), et le ketoprofène (21), réduisaient la progression des maladies parodontales chez les modèles d’animaux. Chez l’homme, les études en coupe et de cohorte ont indiqué que les sujets prenant les médicaments anti-inflammatoires non-stéroïdiens pour le traitement de l’arthrite ou de la spondylarthrite ankylosante ont eu des profondeurs de poche parodontales plus faibles par rapport aux témoins ne prenant aucune médicament anti-inflammatoire non-stéroïdiens (22). En outre, Williams et al. (23) a comparé le taux moyen de perte alvéolaire d’os chez des patients atteints de parodontites chroniques chez qui on a administré du flurbiprofène 50 mg deux fois par jour ou un placebo deux fois par jour pendant une période de deux ans. Ceux qui prenaient du flurbiprofène présentaient une perte osseuse sensiblement inférieure en comparaison aux patients prenant un placebo. Le naxoprène et le méclofénamate de sodium sont efficaces même pour le traitement des parodontite à progression rapide (parodontite agressives) (24, 25). Des études récentes ont prouvé que l’expression de la cyclooxygenase-2 est augmentée dans les tissus gingivaux humains inflammés et que la cyclooxygenase-2 est responsable de la production de la prostaglandine E2 dans les cellules stimulées avec des molécules pro-inflammatoire, ce qui suggère que la cyclooxygenase-2 joue un rôle crucial pour la production de la prostaglandine E2 dans la maladie parodontale.
Les inhibiteurs cyclooxygenase-2 sélectifs sont aussi efficaces que les médicaments anti-inflammatoires non-stéroïdiens traditionnels pour l’inhibition de la progression de la maladie parodontal chez les modèles animaux. Par conséquent, les inhibiteurs de la cyclooxygenase-2 peuvent être efficaces dans le traitement des maladies parodontales, mais les études cliniques plus approfondies sont nécessaires pour le démontrer, non seulement en ce qui concerne la prostaglandine E2 mais également d’autres prostaglandines comme la prostaglandine F2, la prostaglandine I2, le thromboxane A2, et la prostaglandine D2.
La prostaglandine E2 a des effets proinflammatoire et anti-inflammatoires, selon les récepteurs utilisés. Par conséquent, les rôles précis des prostaglandines dans des conditions physiologiques et pathologiques devraient être déterminés par un ensemble complexe d’interactions récepteurs-ligants qui dépendent des facteurs multiples tels que l’affinité du ligant, le profil d’expression de récepteur, l’accouplement différentiel pour le signalement des voies de transduction, et le contexte cellulaire dans lequel le récepteur est exprimé.
La prostaglandine E2 est un produit important pour l’initiation du métabolisme de l’acide arachidonique qui fabrique la cyclooxygenase. La prostaglandine E2 a de multiple effets fonctionnels comme la fièvre, la douleur, la vasodilatation. Mais les prostaglandines sont égalemnt capables, in vitro, de provoquer une résorption osseuse. Leur présence au sein du tissu gingival enflammé a été démontrée aussi bien chez l’animal que chez l’homme, en relation avec la sévérité de la maladie parodontale. Ces observations sont à l’origine de l’utilisation de médicaments inhibant la synthèse des prostaglandines, en l’occurrence les anti-inflammatoires non stéroïdiens, dans le traitement des maladies parodontales (pour revue, voir OFFENBACHER et coll. 1993; HOWELL & WILLIAMS 1993; SALVI 1997).
Les médicaments anti-inflammatoires non-stéroïdiens qui empêchent non sélectivement la synthèse de toutes les prostaglandines.
Les anti-inflammatoires non stéroïdiens agissent toutes par inhibition de la cyclo-oxygénase.
Les cellules du ligament parodontal ont des caractéristiques semblables aux ostéoblastes, comme l’activité des phosphatases alkalines. On a montré que les cellules du ligament parodontale induisaient sous l’effort mécanique l’osteoclastogènèse par l’activation de récepteur nucléaire se liant au facteur-κB par l’intermédiaire de récepteurs EP2/EP4 sous la dépendance de la prostaglandine E2. (étude de Nukaga et al. (26)) Tiranathanagul et al. (27) Ceux ci ont prouvé que le lipopolysaccharide d’actinomycetmcomitans d’A. induisait l’activation de récepteur du ligant nucléaire de facteur-κB par la synthèse des prostaglandines, probablement prostaglandine E2, dans les cellules humaines du ligament parodontales.
Sakata et al. (28) ont démontré que la production d’osteoprotégérine induite par l’interleukin-1β dans les cellules du ligament parodontal a été supprimée par la prostaglandine endogène E2. Ces données suggèrent que des cellules parodontales du ligament stimulées avec des molécules proinflammatoires sont impliquées dans le métabolisme osseux du parodonte en réglant à la foisl’activateur de récepteur se liant au facteur-κB et l’expression nucléaires d’ostéoprotégérine. Très récemment, on a démontré que la prostaglandine E2 augmente la production d’osteoprotégérine dans les fibroblastes gingivaux humains (43). L’effet direct des ostéoclastes sur la prostaglandine E2 est l’inhibition de l’activité de résorption osseuse par l’intermédiaire des récepteurs EP4 (30).
Par conséquent, la prostaglandine E2 joue un rôle important pour la résorption osseuse et la formation d’os, et les récepteurs EP4 peuvent être responsables du règlement de la prostaglandine E2 du métabolisme osseux. On a démontré que l’application locale de la prostaglandine E1 a pour effet de stimuler la formation d’os au niveau d’une canine mandibulaire (31). L’utilisation d’un analogue stable de la prostaglandine E1 chez des modèles de hamster a amélioré le statut osseux (32). On a également remarqué que la libération locale de la prostaglandine E1 augmentait la production de cément, d’os alvéolaire, et la formation de cellules du ligament parodontal chez les chiens adultez (33). Ce traitement a non seulement reconstitué l’os dans le processus alvéolaire mais a également entrainé une formation de néo-cément et du ligament parodontale, ayant pour résultat la régénération du parodonte. Récemment, on a montré que sur des cémentoblastes de souris, la prostaglandine E2 et la prostaglandine F2 exercent un effet anabolique sur la minéralisation par l’activation de la protéine kinase C.
Cependant, Trombelli et al. (138) ont rapporté que le Misoprostol, un analogue de la prostaglandine E1, avait un effet limité sur la régénération osseuse et du cément chez des chiens ayant des défauts parodontaux supra-alvéolaires. On connait désormais les effets de la prostaglandine E sur des activités d’ostéoclastique et ostéoblastique rapporté dans la littérature, mais dees études restent à faire sur les effets cliniques de la prostaglandine E sur le métabolisme osseux et la régénération des tissus parodontaux.
Il existe deux grandes voies de fabrication des prostaglandines :
-Par les COX-1 (cyclo-oxygénase 1), enzymes impliquées dans la protection de la muqueuse gastrique ;
-Par les COX-2 (cyclo-oxygénase 2), enzymes ne s’exprimant qu’au sein des sites inflammatoires où elles sont responsables des douleurs, rougeurs et oedèmes.
Les anti-inflammatoires « classiques » ne font pas la distinction entre les deux enzymes et les combattent de la même manière. En inhibant les deux types de cyclo-oxygénase, ils atténuent certes la douleur mais exposent dans le même temps le patient à des effets digestifs indésirables. En plus de brûlures d’estomac, ils peuvent être à l’origine d’ulcères, voire de perforations et d’hémorragies gastriques. Utilisés par voie orale pour le soulagement des symptômes dans le traitement de l’arthrose ou de la polyarthrite rhumatoïde, une deuxième génération d’anti-inflammatoires, les anti-COX-2 ou coxibs, sont apparus. Grâce à une action spécifique, ils étaient censés épargner la production de prostaglandines protectrices (COX-1) et diminuer la fréquence des troubles gastriques.
Concernant les effets des inhibiteurs spécifiques de la cyclooxygenase-2 (NS-398, nimesulide, etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, paracoxib, valdecoxib, et lumiracoxib. ), sur la progression de la maladie parodontale Bezerra et al.2000 (35) a montré que le meloxicam, cyclooxygenase-2 un inhibiteur sélectif, induisait une résorption réduite d’os de 50%, de même que l’indométhacine, chez les rats qui avaient une parodontiet induite ; le meloxicam induit moins de dommages gastriques que l’indométhacine.
Certains effets secondaires liés à une administration systémique des inhibiteurs de la Cyclooxygénase ont parfois été rapportés: problèmes gastro-intestinaux (pouvant aller jusqu’à la perforation d’un ulcère), troubles nerveux, comme les vertiges ou les céphalées, troubles des fonctions rénales ou pulmonaires. L’apparition de manifestations allergiques est aussi toujours possible.
Depuis la découverte d’une isoforme de la cyclo-oxygénase: la cyclo-oxygénase-2 ou COX-2, d’importantes recherches se sont engagées pour mettre sur le marché un anti-inflammatoire non stéroïdien sélectif qui, n’ayant aucune action sur la cyclo-oxygénase-1 (COX-1), ce qui permettrait d’atténuer les effets secondaires(FUTAKI et coll. 1994; MASFERRER et coll. 1994; MITCHELL et coll. 1994; SEIBERT et coll. 1994; GIERSE et coll. 1995).
Lohinai et al. (36) a également démontré que NS-398 a réduit l’extravasation plasmatique et la résorption d’os alvéolaire chez les rats avec une parodontite induite par des ligatures.
De ces résultats, on a indiqué la possibilité que la cyclooxygenase-2 in vivo soit impliquée dans l’inflammation et la résorption osseuse des parodontites. Cependant, Holzhausen et al. (37) a prouvé que le celecoxib, un inhibiteur de la cyclooxygenase-2 sélectif, a causé une réduction de la perte osseuse après 18 jours d’administration chez des rats avec une parodontite induite par des ligatures par des ligatures, tandis qu’aucune différence significative n’a été observée entre les groupes témoins et examninés après 30 jours. Buduneli et al. (38) a démontré chez des patients atteint de parodontite chronique que le meloxicam a eu une tendance de réduire le taux de collagenase-2 du fluide creviculaire gingival (matrice metalloproteinase-8). Mais que ce soit avec les inhibiteurs de la cyclooxygenase-2 ou les anti-inflammatoires non-stéroïdiens traditionnelles, il n’y a ucune effet persistant c.-à-d. que les effets inhibiteurs peuvent être prévus seulement tant que les médicaments sont administrées (39).
RESUME DES ETUDES SUR L’EFFET DES INHIBITEURS DE LA CYCLO-OXYGENASE 2
-Bezerra et autres.
(Bezerra MM, de Lima V, Alencar VB, Vieira IB, Brito GA, Ribeiro RA, Rocha FA. Selective cyclooxygenase-2 inhibition prevents alveolar bone loss in experimental periodontitis in rats. J Periodontol 2000: 71: 1009–1014.
)
l’effet de l’indométhacine et du meloxicam sur les parodontite induites chez les rats. L’indométhacine et le meloxicam ont empêché la perte d’os alvéolaire
-Lohinai et autres.
(Lohinai Z, Stachlewitz R, Szekely AD, Feher E, Dezsi L, Szabo C. Evidence for the expression of cyclooxygenase-2 enzyme in periodontitis. Life Sci 2001: 70: 279–290.
)
L’effet de NS-398 suodontite induite par des ligatures chez les rats. Extravasation sensiblement réduite du plasma NS-398 et résorption d’os alvéolaire.
-Holzhausen et autres.
(Holzhausen M, Rossa C Jr, Marcantonio E Jr, Nassar PO, Spolidorio DM, Spolidorio LC. Effect of selective cyclooxygenase-2 inhibition on the development of ligature-induced periodontitis in rats. J Periodontol 2002: 73: 1030–1036.
)
L’effet du celecoxib sur la parodontite induite chez les rats. Celecoxib a empêché la perte d’os dans une période plus courte que 30 jours.
-Buduneli et autres.
(Buduneli N, Vardar S, Atilla G, Sorsa T, Luoto H, Baylas H. Gingival crevicular fluid matrix metalloproteinase-8 levels following adjunctive use of meloxicam and initial phase of periodontal therapy. J Periodontol 2002: 73: 103–109.)
l’effet du meloxicam aux niveaux de la matrice de métalloproteinase-8 du fluide creviculaire gingival chez les patients atteints de parodontite chroniques.
Le Meloxicam a délontré une tendance à réduire les niveaux liquides de la matrice de métalloproteinse-8 dans les 10 premiers jours.
-Vardar et autres.
(Vardar S, Baylas H, Huseyinov A. Effects of selective cyclooxygenase-2 inhibition on gingival tissue levels of prostaglandin E2 and prostaglandin F2 and clinical parameters of chronic periodontitis. J Periodontol 2003: 74: 57–63.)
L’effet du nimesulide au niveau des tissus gingivaux sur les de prostaglandine E2 et F2 chez des patients atteints parodontite chronique. Le jour 10, les niveaux de prostaglandine F2 ont diminué de manière significative mais avec un effet insignifiant aux niveaux de la prostaglandine E2.
-Gurgel et autres.
(Gurgel BC, Duarte PM, Nociti FH Jr, Sallum EA, Casati MZ, Sallum AW, de Toledo S. Impact of an anti-inflammatory therapy and its withdrawal on the progression of experimental periodontitis in rats. J Periodontol 2004: 75: 1613–1618.)
L’effet du meloxicam sur la perte d’os dans une parodontite induite chez les rats. Perte d’os réduite par Meloxicam. Aucun effet persistant.
L’idée d’associer des anti-inflammatoires et en particulier des inibiteurs de la cyclooxygenase-2 à un traitement parodontal classique est séduisante, puisque cela permettrait de maîtriser les aspects destructeurs de la réponse de l’hôte. Les résultats, obtenus in vitro et chez l’animal, peuvent être considérés comme prometteurs, mais l’utilisation de ces substances chez l’homme ne semble pas efficace sur les paramètres inflammatoires
cliniques.
L’analyse d’images radiographiques permet toutefois de nuancer ces résultats, puisque de nombreuses études ont montré, chez l’homme, une diminution ou une stabilisation de la résorption osseuse, après administration de tels médicaments.
Rappelons cependant que l’effet bénéfique de ces produits sur l’os alvéolaire ne semble pas pouvoir être maintenu après cessation de leur administration.
SOURCES
Periodontology 2000
Volume 43 Issue 1 Page 85 – February 2007
Kazuyuki Noguchi, Isao Ishikawa (2007)
The roles of cyclooxygenase-2 and prostaglandin E2 in periodontal disease
Periodontology 2000 43 (1), 85–101.
doi:10.1111/j.1600-0757.2006.00170.x
2. A c t a M e d D e n t H e l v , V o l 4 : 1 / 1 9 9 9
REFERENCES
1.Williams CS, Mann M, DuBois RN. The role of cyclooxygenases in inflammation, cancer, and development. Oncogene 1999: 18: 7908–7916.
2.Kujubu DA, Fletcher BS, Varnum BC, Lim RL, Hershman HR. TIS10, a phorbol ester tumor promoter-inducible mRNA from Swiss 3T3 cells, encodes a novel prostaglandin synthase/cyclooxygenase homologue. J Biol Chem 1991: 266: 12866–12872.
3.Xie W, Chipman JG, Robertson DL, Erikson RL, Simmons DL. Expression of a mitogen-responsive gene encoding prostaglandin synthase is regulated by mRNA splicing. Proc Natl Acad Sci U S A 1991: 88: 2692–2696.
4.Paquette DW, Williams RC. Modulation of host inflammatory mediators as a treatment strategy for periodontal diseases. Periodontol 2000 2000: 24: 239–252.
,
5.ElAttar TM. Prostaglandin E2 in human gingiva in health and disease and its stimulation by female sex steroids. Prostaglandins 1976: 11: 331–341.
CrossRef, Medline
6.Ohm K, Albers HK, Lisboa BP. Measurement of eight prostaglandins in human gingival and periodontal disease using high pressure liquid chromatography and radioimmunoassay. J Periodontal Res 1984: 19: 501–511.
,
7.Goodson JM, Dewhirst FE, Brunetti A. Prostaglandin E2 levels and human periodontal disease. Prostaglandins 1974: 6: 81–85.
CrossRef, Medline
8.Offenbacher S, Odle BM, Gray RC, Van Dyke TE. Crevicular fluid prostaglandin E levels as a measure of the periodontal disease status of adult and juvenile periodontitis patients. J Periodontal Res 1984: 19: 1–13.
,
9.Offenbacher S, Odle BM, Van Dyke TE. The use of crevicular fluid prostaglandin E2 levels as a predictor of periodontal attachment loss. J Periodontal Res 1986: 21: 101–112.
,
10.Roberts FA, Houston LS, Lukehart SA, Mancl LA, Persson GR, Page RC. Periodontitis vaccine decreases local prostaglandin E2 levels in a primate model. Infect Immun 2004: 72: 1166–1168.
11.Nyman S, Schroeder HE, Lindhe J. Suppression of inflammation and bone resorption by indomethacin during experimental periodontitis in dogs. J Periodontol 1979: 50: 450–461.
Medline,
12.Williams RC, Jeffcoat MK, Howell TH, Hall CM, Johnson HG, Wechter WJ, Goldhaber P. Indomethacin or flurbiprofen treatment of periodontitis in beagles: comparison of effect on bone loss. J Periodontal Res 1987:
13.Williams RC, Offenbacher S, Jeffcoat MK, Howell TH, Johnson HG, Hall CM, Wechter WJ, Goldhaber P. Indomethacin or flurbiprofen treatment of periodontitis in beagles: effect on crevicular fluid arachidonic acid metabolites compared with effect on alveolar bone loss. J Periodontal Res 1988: 23: 134–138.
14 Williams RC, Jeffcoat MK, Kaplan ML, Goldhaber P, Johnson HG, Wechter WJ. Flurbiprofen: a potent inhibitor of alveolar bone resorption in beagles. Science 1985: 227: 640–642.
15.Williams RC, Jeffcoat MK, Howell TH, Reddy MS, Johnson HG, Hall CM, Goldhaber P. Topical flurbiprofen treatment of periodontitis in beagles. J Periodontal Res 1988: 23: 166–169.
,
16 Williams RC, Jeffcoat MK, Howell TH, Reddy MS, Johnson HG, Hall CM, Goldhaber P. Ibuprofen: an inhibitor of alveolar bone resorption in beagles. J Periodontal Res 1988: 23: 225–229.
,
17.Howell TH, Jeffcoat MK, Goldhaber P, Reddy MS, Kaplan ML, Johnson HG, Hall CM, Williams RC. Inhibition of alveolar bone loss in beagles with the NSAID naproxen. J Periodontal Res 1991: 26: 498–501.
,
18.Offenbacher S, Williams RC, Jeffcoat MK, Howell TH, Odle BM, Smith MA, Hall CM, Johnson HG, Goldhaber P. Effects of NSAIDs on beagle crevicular cyclooxygenase metabolites and periodontal bone loss. J Periodontal Res 1992: 27: 207–213.
,
19.Kornman KS, Blodgett RF, Brunsvold M, Holt SC. Effects of topical applications of meclofenamic acid and ibuprofen on bone loss, subgingival microbiota and gingival PMN response in the primate Macaca fascicularis. J Periodontal Res 1990: 25: 300–307.
,
20.Howell TH, Fiorellini J, Weber HP, Williams RC. Effect of the NSAID piroxicam, topically administered, on the development of gingivitis in beagle dogs. J Periodontal Res 1991: 26: 180–183.
,
21.Li KL, Vogel R, Jeffcoat MK, Alfano MC, Smith MA, Collins JG, Offenbacher S. The effect of ketoprofen creams on periodontal disease in rhesus monkeys. J Periodontal Res 1996: 31: 525–532.
22.Waite IM, Saxton CA, Young A, Wagg BJ, Corbett M. The periodontal status of subjects receiving non-steroidal anti-inflammatory drugs. J Periodontal Res 1981: 16: 100–108.
,
23.Williams RC, Jeffcoat MK, Howell TH, Rolla A, Stubbs D, Teoh KW, Reddy MS, Goldhaber P. Altering the progression of human alveolar bone loss with the non-steroidal anti-inflammatory drug flurbiprofen. J Periodontol 1989: 60: 485–490.
Medline,
24.Jeffcoat MK, Page R, Reddy M, Wannawisute A, Waite P, Palcanis K, Cogen R, Williams RC, Basch C. Use of digital radiography to demonstrate the potential of naproxen as an adjunct in the treatment of rapidly progressive periodontitis. J Periodontal Res 1991: 26: 415–421.
,
25.Reddy MS, Palcanis KG, Barnett ML, Haigh S, Charles CH, Jeffcoat MK. Efficacy of meclofenamate sodium (Meclomen) in the treatment of rapidly progressive periodontitis. J Clin Periodontol 1993: 20: 635–640.
,
26.Nukaga J, Kobayashi M, Shinki T, Song H, Takada T, Takiguchi T, Kamijo R, Hasegawa K. Regulatory effects of interleukin-1β and prostaglandin E2 on expression of receptor activator of nuclear factor-κB ligand in human periodontal ligament cells. J Periodontol 2004: 75: 249–259.
27.Tiranathanagul S, Yongchaitrakul T, Pattamapun K, Pavasant P. Actinobacillus actinomycetemcomitans lipopolysaccharide activates matrix metalloproteinase-2 and increases receptor activator of nuclear factor-κB ligand expression in human periodontal ligament cells. J Periodontol 2004: 75: 1647–1654.
28.Sakata M, Shiba H, Komatsuzawa H, Fujita T, Uchida Y, Yoshino H, Ogawa T, Kawaguchi H, Kurihara H. Osteoprotegerin levels increased by interleukin-1beta in human periodontal ligament cells are suppressed through prostaglandin E2 synthesized de novo. Cytokine 2002: 18: 133–139.
29.Hormdee D, Nagasawa T, Kiji M, Yashiro R, Kobayashi H, Koshy G, Noguchi K, Nitta H, Ishikawa I. Protein kinase A-dependent osteoprotegerin production on interleukin-1 stimulation in human gingival fibroblasts is distinct from periodontal ligament fibroblasts. Clin Exp Immunol 2005: 142: 490–497.
System
30.Mano M, Arakawa T, Mano H, Nakagawa M, Kaneda T, Kaneko H, Yamada T, Miyata K, Kiyomura H, Kumegawa M, Hakeda Y. Prostaglandin E2 directly inhibits bone-resorbing activity of isolated mature osteoclasts mainly through the EP4 receptor. Calcif Tissue Int 2000: 67: 85–92.
31.Marks SC Jr, Miller SC. Local infusion of prostaglandin E1 stimulates mandibular bone formation in vivo. J Oral Pathol 1988: 17: 500–505.
32.Caillon P, Saffar JL. Improvement of gingival and alveolar bone status in periodontitis-affected hamsters treated with 15-methyl prostaglandin E1. J Periodontal Res 1994: 29: 138–145.
33.Marks SC Jr, Miller SC. Local delivery of prostaglandin E1 induces periodontal regeneration in adult dogs. J Periodontal Res 1994: 29: 103–108.
,
34.Trombelli L, Lee MB, Promsudthi A, Guglielmoni PG, Wikesjo UM. Periodontal repair in dogs: histologic observations of guided tissue regeneration with a prostaglandin E1 analog/methacrylate composite. J Clin Periodontol 1999: 26: 381–387.
,
35.Bezerra MM, de Lima V, Alencar VB, Vieira IB, Brito GA, Ribeiro RA, Rocha FA. Selective cyclooxygenase-2 inhibition prevents alveolar bone loss in experimental periodontitis in rats. J Periodontol 2000: 71: 1009–1014.
36.Lohinai Z, Stachlewitz R, Szekely AD, Feher E, Dezsi L, Szabo C. Evidence for the expression of cyclooxygenase-2 enzyme in periodontitis. Life Sci 2001: 70: 279–290.
37.Holzhausen M, Rossa C Jr, Marcantonio E Jr, Nassar PO, Spolidorio DM, Spolidorio LC. Effect of selective cyclooxygenase-2 inhibition on the development of ligature-induced periodontitis in rats. J Periodontol 2002: 73: 1030–1036.
38.Buduneli N, Vardar S, Atilla G, Sorsa T, Luoto H, Baylas H. Gingival crevicular fluid matrix metalloproteinase-8 levels following adjunctive use of meloxicam and initial phase of periodontal therapy. J Periodontol 2002: 73: 103–109.
39.Gurgel BC, Duarte PM, Nociti FH Jr, Sallum EA, Casati MZ, Sallum AW, de Toledo S. Impact of an anti-inflammatory therapy and its withdrawal on the progression of experimental periodontitis in rats. J Periodontol 2004: 75: 1613–1618.