Ce document conceptuel de traitement présente un outil d’évaluation des risques pour un patient de développer une péri-implantite.
Ce diagramme d’évaluation des risques fonctionnels a été construit en incorporant huit paramètres, chacun avec des preuves documentées d’une association avec une péri-implantite.
La combinaison de ces facteurs dans un outil d’évaluation des risques, IDRA, peut être utile pour
individus à risque de développer une péri-implantite.
Dans les dernières décennies, l’évaluation des risques est devenue le centre d’attention de la recherche clinique. Plusieurs outils d’évaluation des risques parodontaux ont été développés et validés à des degrés divers (Heitz-Mayfield, 2005; Lang, Suvan et Tonetti, 2015). Lors du 11e atelier européen sur
Parodontologie (2015), cinq outils d’évaluation des risques ont été traités dans une revue systématique (Lang et al., 2015). Sur les cinq, un outil d’évaluation des risques, l’évaluation des risques parodontaux (ERP) (Lang & Tonetti, 2003) a été souligné comme ayant été validé dans neuf études internationales. Touyes des études ont indiqué que les patients à haut risque de réinfection parodontale et de progression de la maladie après un traitement parodontal actif a pu être identifié en utilisant les six critères de l’ARP. Celles-ci Les critères sont résumés dans un diagramme fonctionnel hexagonal, qui identifie les patients comme étant soit des patients à risque faible, modéré ou élevé.
Le PRA est disponible sur Internet (http://www.periotools.com/PRA) en 23 langues et est disponible gratuitement. Par conséquent, la PRA est largement utilisé par la profession avec une fréquence de plus de 500 visites par jour.
Étant donné que l’étiologie et la pathogenèse des maladies péri-implantaires reçoivent une attention croissante, il est le temps de développer un outil d’évaluation des risques similaire pour la prédiction du développement de la périimplantite. Bien qu’une évaluation des risques évalue principalement le risque du sujet, elle peut également le site implantaire. L’évaluation du risque de maladie implantaire (IDRA) est utilisée dans le but de minimiser les risques de développer une rupture du tissu péri-implantaire. En comprenant la clé facteurs associés au développement de maladies péri-implantaires documentés dans la littérature le clinicien peut aborder de manière sélective ces facteurs pour améliorer les résultats de la thérapie implantaire.
L’IDRA peut être utilisé pour évaluer le risque pour les patients édentés et partiellement dentés.
Cependant, avec des patients édentés, il peut y avoir certaines limites.
Les analyses des résultats d’études récentes portant sur les facteurs / indicateurs de risque de
les complications associées aux implants dentaires ont identifié huit facteurs importants, énumérés
ci-dessous, qui peuvent contribuer au développement de la péri-implantite.
Attribution du risque
Cette publication introduit un outil d’évaluation du risque, l’Evaluation du Risque de Maladie Implantaire (IDRA pour Implant Disease Risk Assessment ). Cet outil évalue le risque pour nos patients de développer une maladie péri implantaire.
Le diagramme d’évaluation des risque est construit en incorporant 8 paramètres, chacun faisant état de publications établissant leur association avec le développement de maladie péri implantaire.
Les 8 vecteurs de ce diagramme sont:
(1) l’historique d’antécédent de maladie parodontale
(2) le pourcentage de site présentant un saignement au sondage (BOP)
(3) Le nombre de dents/implants avec des profondeurs de sondage supérieures ou égales à 5 mm (PD) ≥5mm
(4) le pourcentage de perte osseuse évalue sur radio et concordance avec l’âge du patient
(5) la susceptibilité à la parodontite comme décrite par le stade et le grade de la nouvelle classification des maladies parodontales de 2017
(6) la fréquence et la complaisance avec une thérapeutique de soutien parodontale
(7) la distance, en mm, entre les limites de là restaurations prothétique implanto portée et l’os marginal
(8) les facteurs liés à la restauration prothétique incluant les possibilités de mesures d’hygiènes et son adaptation marginale.
La combinaison des ces facteurs dans cet outil d’évaluation des risques (IDRA) trouve un intérêt certain dans l’identification du risque individuel du développement de maladie péri implantaire.
Ces huit paramètres ont été combinés dans un octogone qui visualise le risque de développement de la maladie (figure 1). Une évaluation complète utilisant ce diagramme fonctionnel fournira
un profil de risque total individuel et déterminer la nécessité de mesures ciblant la réduction des risques.
Chaque vecteur a sa propre échelle pour les profils de risque. Au fur et à mesure que des facteurs supplémentaires des modifications de la littérature du diagramme peuvent être appropriées.
Hygiène buccale
Il existe des preuves accablantes que les biofilms bactériens sont les agents étiologiques les plus importants pour l’initiation et la progression des maladies péri-implantaires (Berglundh et al., 2018).
Les études sur l’évaluation du contrôle de la plaque auto-effectué a montré une forte association avec un mauvais contrôle de plaque et une péri-implantite (Schwarz, Derks, Monje et Wang, 2018). Chez les patients ayant des antécédents de parodontite, la prévalence de la maladie péri-implantaire était plus élevée lorsque le FMPS était supérieur à 25% (Aguirre-Zorzano, Estefania-Fresco, Telletxea et Bravo, 2015). Cependant, les études n’ont pas encore identifié le niveau de contrôle du biofilm compatible avec le maintien de la santé péri-implantaire. Dans De plus, un score de plaque obtenu à un moment donné ne reflète pas nécessairement les niveau de routine de contrôle de la plaque auto-exécuté. La réponse de l’hôte au biofilm est considérée plus important que le score de plaque en soi, il est donc approprié de relier le score de plaque à le paramètre inflammatoire saignant sur le pourcentage de sondage (BOP%). D’où le pourcentage de La BOP plutôt que le score complet de plaque buccale (FMPS) est inclus comme paramètre dans le diagramme d’évaluation de risque.
1. Antécédents de parodontite
Les études longitudinales et transversales montrent clairement que les patients ayant des antécédents
des parodontites sont sensibles à la péri-implantite (Derks et al., 2016; Karoussis et al., 2003;
Kordbacheh Changi, Finkelstein et Papapanou, 2019; Roccuzzo, De Angelis, Bonino et Aglietta,
2010). Par conséquent, un patient qui a des antécédents de parodontite ou qui a perdu des dents doit être remplacé par les implants dus à la parodontite présentent un risque élevé. En revanche, un patient ayant perdu des dents en raison de caries, un traumatisme ou une agénésie présente un faible risque de développement de péri-implantite. L’histoire de la parodontite peut être évaluée en évaluant la présence d’une perte osseuse parodontale radiographies, ou en examinant les dossiers dentaires pour déterminer la raison de la perte de dents. Le patient peut également être en mesure de fournir la raison de la perte de dents.
2. Pourcentage de sites avec BOP
Le saignement au sondage doux représente un paramètre inflammatoire objectif, qui a été incorporé dans des systèmes d ‘index connus, pour l’ évaluation de la parodontie (Löe & Silness, 1963;
Mühlemann, 1973) et les conditions péri-implantaires (Mombelli, van Oosten, Schürch & Lang, 1987).
Le pourcentage de sites avec BOP peut également être utilisé comme paramètre d’évaluation individuel
représentant la réponse de l’hôte au défi bactérien.
L’incorporation du BOP% dans l’ARP a établi une prévalence de BOP de 25% comme seuil
entre les patients qui ont maintenu la stabilité parodontale pendant quatre ans et les patients
maladie récurrente dans le même laps de temps (Joss, Adler et Lang, 1994; Matuliene et al., 2008).
Autres preuves de BOP% (compris entre 20 et 30%) déterminant un risque plus élevé de parodontie
la progression de la maladie a été démontrée dans un certain nombre d’études (Badersten, Nilveus, & Egelberg, 1990; Claffey, Nylund, Kiger, Garrett et Egelberg, 1990; Matuliene et al., 2008). Le saignement sur le sondage sur les sites d’implantation s’est également révélé être associé à la progression de la maladie (Karlsson et al., 2019; Luterbacher, Mayfield, Brägger et Lang, 2000; Giovanni Serino & Turri, 2011). le pourcentage de BOP est donc utilisé comme deuxième indicateur de risque dans le schéma fonctionnel IDRA.
L’échelle fonctionne en mode quadratique de 4, 9, 16, 25, 36 et> 49% étant les valeurs critiques sur le
vecteur. Cette évaluation englobe le BOP% pour tous les sites dentaires et implantaires. Individus avec un faible BOP% (<10%) peut être considéré comme un patient à faible risque de développer une maladie (Lang, Adler, Joss et Nyman, 1990), tandis que les patients avec un BOP%> 25% devraient être considérés risque plus élevé de rupture des tissus.
3. Prévalence des profondeurs de sondage ≥ 5 mm
Un nombre élevé de poches parodontales profondes (PD ≥ 5 mm) et un approfondissement des poches pendant été associée à un risque élevé de progression de la maladie parodontale (Badersten et al., 1990; Claffey et al., 1990). Il a également été démontré que des agents pathogènes parodontaux putatifs provenant de des poches au niveau des dents peuvent coloniser les sites d’implantation (Mombelli, Marxer, Gaberthuel, Grunder, & Lang, 1995). En outre, la présence d’un nombre plus élevé de poches résiduelles était associée à développement de la péri-implantite dans le milieu (Cho-Yan Lee, Mattheos, Nixon et Ivanovski, 2012) à long terme (Pjetursson et al., 2012). Pour évaluer le risque de maladie péri-implantaire du patient développement, le nombre de sites dentaires et implantaires avec une PD ≥ 5 mm est évalué comme le troisième indicateur de risque dans le diagramme fonctionnel IDRA. L’échelle fonctionne en mode linéaire avec 2, 4, 6, 8, ≥10 étant les valeurs critiques sur ce vecteur. Les individus avec une ou deux poches avec un PD ≥ 5 mm peuvent être considérés comme des patients à faible risque, tandis que les patients avec plus de six sites avec PD ≥ 5 mm sont
considérés comme des individus à haut risque de développer des complications biologiques.
4. Perte osseuse parodontale par rapport à l’âge
L’ampleur et la prévalence de la perte d’attache parodontale évaluée par la hauteur de l’alvéolaire
os sur les radiographies, peut représenter l’indicateur le plus évident du risque de parodontie chez le sujet de progression de la maladie en fonction de l’âge du patient (Papapanou, Wennström, & Gröndahl,
1988).
La perte osseuse parodontale a été identifiée comme un facteur de risque pour le développement du péri-implant dans deux grandes études de population sélectionnées au hasard (Derks et al., 2016; Kordbacheh Changi et al., 2019). Par conséquent, l’ampleur de la perte osseuse alvéolaire par rapport à l’âge du patient est estimé comme le quatrième indicateur de risque de développement de la maladie dans le diagramme IDRA fonctionnel.
L’estimation de la perte d’os alvéolaire est réalisée dans les deux radiographies périapicales dans lesquelles le pire site dentaire affecté est grossièrement estimé en% de la longueur de la racine ou sur la morsure radiographies dans lesquelles le pire site affecté est estimé en mm. Sur les radiographies de morsure 1 mm est considérée comme égale à 10% de perte osseuse. Le pourcentage est ensuite divisé par l’âge des patients résultant en un facteur. A titre d’exemple, un patient de 40 ans avec 20% de perte osseuse au pire le site affecté obtiendrait BL / âge = 0,5. Un autre patient de 40 ans avec une perte osseuse de 50% au le site le plus touché obtiendrait BL / âge = 1,5.
L’échelle fonctionne par incréments de 0,25 du facteur BL / âge, 0,5 étant la valeur critique pour
faire la distinction entre un risque faible et modéré et 1,0 étant la valeur pour un risque modéré et élevé.
Cela signifie à son tour qu’un patient qui a perdu un pourcentage plus élevé de l’os alvéolaire que
son âge est fortement exposé à ce vecteur dans une évaluation multifactorielle.
5. Sensibilité à la parodontite
En 2017, l’Atelier mondial sur la classification des maladies parodontales et péri-implantaires
a proposé un nouveau système de classification des maladies parodontales couvrant l’étendue,
gravité et complexité dans une modalité de mise en scène (Tonetti et al., 2018). De plus, la progression
taux et donc la sensibilité à la maladie a été incorporé avec une modalité de classement (Tonetti et
al., 2018).
Il semble donc logique d’ajouter le stade et le classement de la maladie parodontale comme vecteur influencer le développement et la progression de la maladie pour les maladies péri-implantaires.
Selon l’IDRA (figure 1), seul le stade 1 de grade A représente un faible risque. L’étape 2 représente
risque modéré (du nœud central dans la plage modérée) ou plus élevé. L’étape 3 représente
risque modéré (à partir du nœud externe dans la plage modérée) ou supérieur. L’étape 4 représente haut
risque. En ce qui concerne le classement: le grade B représente modéré (à partir du nœud central dans le modéré ou un risque plus élevé et le grade C représente un risque élevé.
Le nombre de dents perdues à cause de la parodontite est intégré dans le Classement 2017.
Comme les preuves d’une association avec la péri-implantite restent équivoques concernant la cigarette
tabagisme et diabète sucré, ces facteurs modificateurs sont considérés comme des indicateurs de risque potentiels ou des facteurs de risque émergents (Schwarz et al., 2018). Par conséquent, ils ne sont pas représentés dans l’IDRA par vecteurs individuels, au lieu de cela, ils sont incorporés dans le classement de la classification de 2017 des maladies parodontales. Cette classification attribue un non-fumeur au grade A (taux de progression), un fumeur <10 cigarettes par jour est de grade B (taux de progression modéré) et un fumeur ≥ 10 cigarettes par jour représente le grade C (risque élevé de progression).
Un patient sans diagnostic de diabète se voit attribuer le grade A (taux de progression lent). UNE
patient diabétique et HbA1c <7,0% est de grade B (taux de progression modéré) et HbA1c ≥
7,0% est de grade C (taux de progression rapide).
6. Thérapie parodontale de soutien (SPT)
Il existe des preuves solides qu’un système de rappel régulier offrant des soins de maintenance appropriés est importance primordiale pour la santé et la stabilité péri-implantaires (Costa et al., 2012; Monje et al., 2016; Roccuzzo, Bonino, Aglietta et Dalmasso, 2012). Par conséquent, le sixième vecteur des accords IDRA avec la conformité des patients et les soins de soutien dispensés par le clinicien. De toute évidence, non les soins de maintenance représentent un risque élevé de développement d’une maladie péri-implantaire le respect d’un intervalle d’entretien recommandé et calculé entraîne un faible risque de développement de la maladie. Une revue systématique (Monje et al., 2016) a déterminé qu’un intervalle de rappel inférieure ou égale à 5 mois, peut représenter en moyenne un délai compatible avec le maintien de la santé péri-implantaire.
7. Distance entre le bord de restauration de la prothèse implanto-portée et l’os
Une grande étude de population a identifié la distance ≤ 1,5 mm de la marge de restauration du
prothèse implanto-portée sur la crête osseuse marginale au moment de la restauration comme indicateur de risque pour la péri-implantite (Derks et al., 2016). Il est donc pertinent de considérer cette distance dans un risque évaluation du développement de la péri-implantite. Alors qu’un implant au niveau des tissus mous a généralement une marge de restauration supramucosale et représente donc un faible risque de développement de la maladie, un
la distance de la marge de restauration à la crête osseuse de ≤ 1,5 mm a été établie à
risque plus élevé. Par conséquent, le diagramme fonctionnel IDRA attribue un faible risque pour un implant au niveau des tissus mous, risque modéré à une distance de 1,5 mm et risque élevé à une distance <1,5 mm. C’est déterminé à partir d’une radiographie réalisée au moment de la restauration. Si une radiographie au moment de la livraison de la prothèse n’est pas disponible, une radiographie doit être prise au moment de l’examen et l’évaluation des risques.
8. Facteurs liés à l’implant et à la prothèse
Plusieurs études ont indiqué que la conception et les contours de la prothèse implanto-portée
peut conduire à des zones non nettoyables. Par conséquent, les biofilms s’accumulent et peuvent initier
maladie péri-implantaire (G. Serino & Ström, 2009). En outre, des facteurs iatrogènes tels que la mauvais ajustement marginal et les excès de ciment sous-muqueux fournissent des habitats pour l’accumulation de biofilm et sont donc des facteurs documentés pour le développement de complications biologiques. Récemment, cela a été confirmé dans une vaste étude de population réalisée par (Kordbacheh Changi et al., 2019). Pour représenter un faible risque de développement de la maladie, la prothèse doit être bien ajustée, nettoyable, vissé ou sans excès de ciment. Inversement, une prothèse mal ajustée et non nettoyable est à haut risque pour permettre l’accumulation de biofilm et donc développer une maladie péri-implantaire. Le même principe s’applique pour la présence d’un excès de ciment sous-muqueux. Un risque modéré peut être attribué à une prothèse qui a compromis l’ajustement mais les marges supramucosales accessibles. Dans le cadre de l’IDRA, le terme nettoyable fait référence à l’accès tant du clinicien que du patient pour nettoyer prothèse. La capacité du patient à nettoyer la prothèse dépendra de son niveau de compétence et dextérité qui peut évoluer avec le temps.
Calcul de l’évaluation individuelle du risque de maladie implantaire du patient IDRA
Sur la base des huit paramètres spécifiés ci-dessus, un diagramme multifonctionnel (octogone) est
construit pour l’IDRA (figure 1). Dans ce diagramme, les vecteurs ont été formés sur la base de
les preuves scientifiques disponibles. Il est prévu que la validation en cours puisse entraîner une légère
modifications.
Un patient à faible IDRA a tous les paramètres dans les catégories à faible risque ou au plus un paramètre dans la catégorie à risque modéré (figure 2).
Un patient IDRA modéré a au moins deux paramètres dans la catégorie à risque modéré mais au plus
un paramètre dans la catégorie à haut risque (figure 3). Un patient IDRA modéré peut également en avoir un paramètre dans la catégorie à haut risque avec tous les autres paramètres dans les catégories à faible risque.
Un patient IDRA à haut risque a au moins deux paramètres dans la catégorie à haut risque (figure 4).
Chez un patient à haut risque qui produit un% de BOP élevé et un nombre élevé de poches résiduelles (PD ≥5 mm) le risque de développement d’une maladie péri-implantaire du patient peut être réduit en un IDRA modéré catégorie si une autre thérapie parodontale réussie est fournie. Alors que ces deux paramètres (% BOP, PD≥5mm) sont facilement modifiés par une thérapie adéquate d’autres paramètres tels que l’ajustement de la prothèse peut nécessiter le remplacement de la prothèse.
Deux facteurs dans l’IDRA, les antécédents de parodontite et de sensibilité à la parodontite, ne peuvent être modifiés et doivent donc être acceptés comme acquis. La compensation de ce risque élevé peut être obtenu en minimisant l’effet des autres paramètres.
Chez un patient édenté restauré avec une prothèse implanto-portée où la les antécédents de parodontite ne peuvent pas être déterminés ce paramètre n’est pas attribué. De plus, dans un
patient édenté il n’est pas possible d’attribuer le paramètre perte osseuse / âge.
Si un patient a des antécédents de péri-implantite, l’évaluation des risques pour le paramètre «antécédents de parodontite »doit être considérée comme élevée.
Cet outil d’évaluation des risques IDRA nécessitera une validation rétrospective ou prospective
études dans plusieurs milieux de pratique privée et universitaire.
En conclusion, l’IDRA peut être un outil utile pour évaluer le risque pour un individu
patient après la thérapie implantaire. En outre, l’IDRA peut être utile comme liste de contrôle pour identifier risques modifiables avant la thérapie implantaire et comme outil pour le clinicien de communiquer le niveau de risque pour le patient.
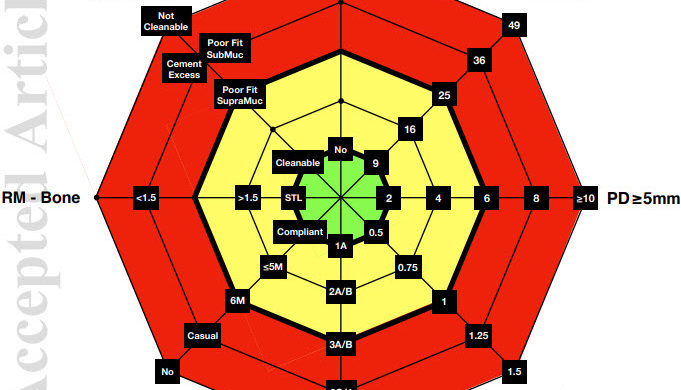
Figure 1
Diagramme fonctionnel de l’évaluation du risque de maladie implantaire (IDRA)
Chaque vecteur représente un paramètre de risque avec une zone de risque relatif. Quand les facteurs sont évalués ensemble, le faible risque est représenté par la zone située au centre de l’octogone (vert
ombres). Le risque modéré est représenté par l’aire de l’octogone entre le premier et le
deuxième anneau en gras (ombrage jaune). Le risque élevé est représenté par la zone en dehors de la seconde anneau gras de l’octogone (ombrage rouge).
Paramètres
Hystory of Perio Histoire de la parodontite (oui / non)
BOP% Pourcentage de sites d’implants et de dents avec BOP positifPD ≥ 5 mm Nombre de sites avec PD ≥ 5 mm au niveau des implants et des dents
BL / Âge Perte osseuse parodontale par rapport à l’âge du patient
La perte osseuse est estimée à partir d’une radiographie périapicale ou de morsure au niveau des
dent – Dans les radiographies périapicales, le% de perte osseuse alvéolaire est comparé à la distance 1
mm apical de la jonction ciment-émail à l’apex racinaire. Dans les radiographies mordues, le
Le% de perte osseuse alvéolaire est calculé avec 10% pour 1 mm.
Perio-sensibilité La sensibilité du patient à la parodontite
Thérapie parodontale de soutien SPT
(Conforme au SPT, intervalle de rappel ≤ 5 mois, intervalle de rappel 6 mois, accompagnateur occasionnel, non
thérapie de soutien)
RM – Distance osseuse entre la marge de restauration (RM) de la prothèse implantaire et la
crête osseuse marginale (STL – implant au niveau des tissus mous,> 1,5 mm, <1,5 mm). Ceci est déterminé à partir d’une radiographie.
Prothèse. Évaluation des facteurs liés à la prothèse implanto-portée.
(nettoyable, mauvais ajustement avec les marges supramuqueuses, mauvais ajustement avec les marges sous-muqueuses, excès de ciment non nettoyable)
Figure 2
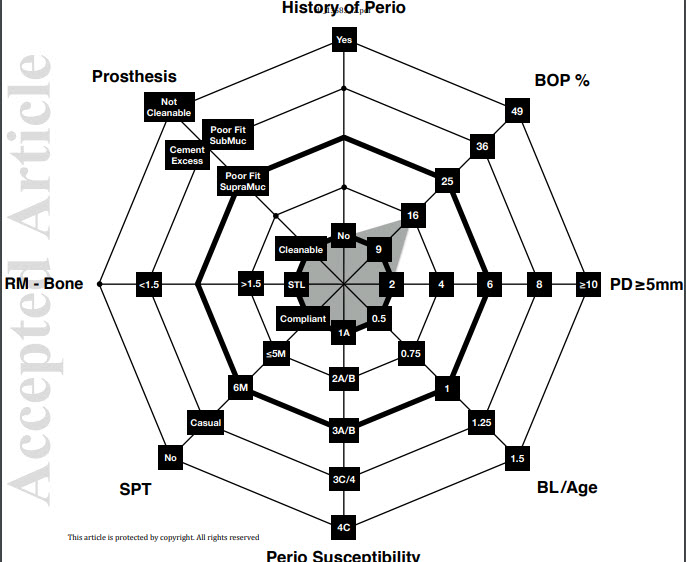
Un patient à faible risque IDRA a tous les paramètres dans les catégories à faible risque ou au plus un
dans la catégorie à risque modéré.
figure 3
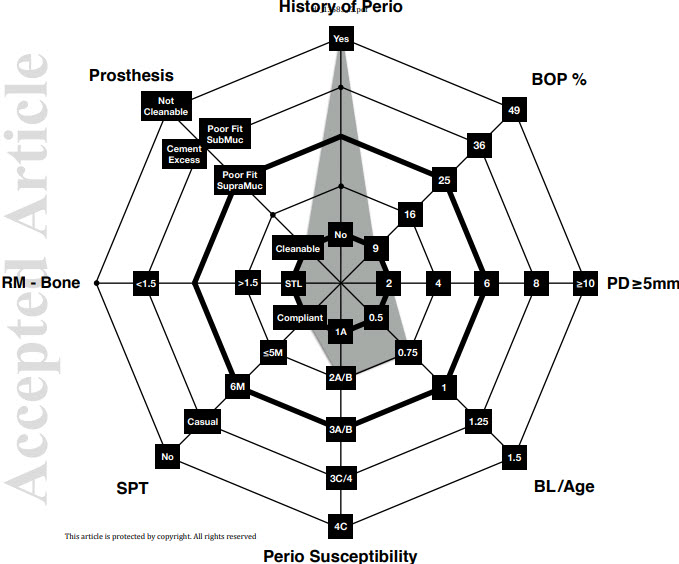
Un patient à risque modéré IDRA a au moins deux paramètres dans la catégorie à risque modéré mais
au plus un paramètre dans la catégorie à haut risque.
Figure 4
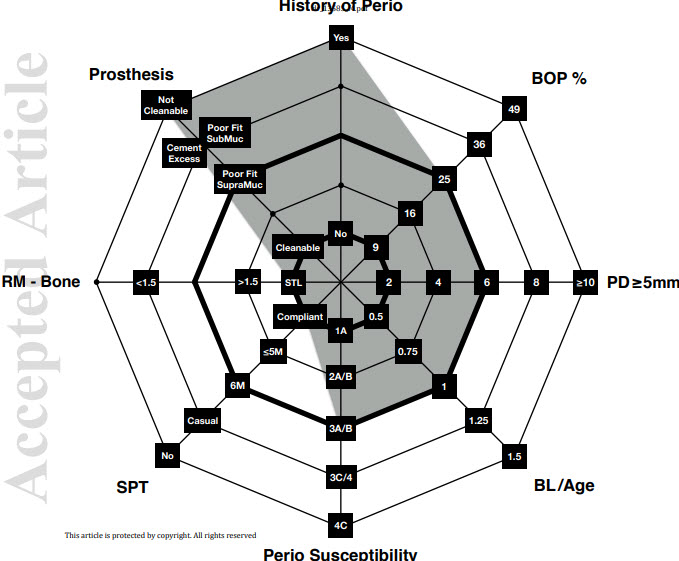
Un patient à haut risque IDRA a au moins deux paramètres dans la catégorie à haut risque.
Références
-Aguirre-Zorzano, L. A., Estefania-Fresco, R., Telletxea, O., & Bravo, M. (2015). Prevalence of periimplant inflammatory disease in patients with a history of periodontal disease who
receive supportive periodontal therapy. Clinical Oral Implants Research, 26(11), 1338-
1344. doi:https://dx.doi.org/10.1111/clr.12462
-Badersten, A., Nilveus, R., & Egelberg, J. (1990). Scores of plaque, bleeding, suppuration and
probing depth to predict probing attachment loss. 5 years of observation following
nonsurgical periodontal therapy. Journal of Clinical Periodontology, 17(2), 102-107.
-Berglundh, T., Armitage, G., Araujo, M. G., Avila-Ortiz, G., Blanco, J., Camargo, P. M., . . .
Zitzmann, N. (2018). Peri-implant diseases and conditions: Consensus report of
workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and PeriImplant Diseases and Conditions. Journal of Periodontology, 89 Suppl 1, S313-S318.
doi:10.1002/JPER.17-0739
-Cho-Yan Lee, J., Mattheos, N., Nixon, K. C., & Ivanovski, S. (2012). Residual periodontal pockets
are a risk indicator for peri-implantitis in patients treated for periodontitis. Clinical Oral
Implants Research, 23(3), 325-333. doi:http://dx.doi.org/10.1111/j.1600-
0501.2011.02264.x
-Claffey, N., Nylund, K., Kiger, R., Garrett, S., & Egelberg, J. (1990). Diagnostic predictability of
scores of plaque, bleeding, suppuration and probing depth for probing attachment loss. 3
1/2 years of observation following initial periodontal therapy. Journal of Clinical
Periodontology, 17(2), 108-114.
-Costa, F. O., Takenaka-Martinez, S., Cota, L. O., Ferreira, S. D., Silva, G. L., & Costa, J. E. (2012).
Peri-implant disease in subjects with and without preventive maintenance: a 5-year
follow-up. Journal of Clinical Periodontology, 39(2), 173-181. doi:10.1111/j.1600-
051X.2011.01819.x
-Derks, J., Schaller, D., Hakansson, J., Wennström, J. L., Tomasi, C., & Berglundh, T. (2016).
Effectiveness of Implant Therapy Analyzed in a Swedish Population: Prevalence of Periimplantitis. Journal of Dental Research, 95(1), 43-49. doi:10.1177/0022034515608832
Accepted Article
This article is protected by copyright. All rights reserved
-Heitz-Mayfield, L. J. (2005). Disease progression: identification of high-risk groups and individuals
for periodontitis. Journal of Clinical Periodontology, 32 Suppl 6, 196-209. doi:CPE803 [pii]
10.1111/j.1600-051X.2005.00803.x
-Joss, A., Adler, R., & Lang, N. P. (1994). Bleeding on probing. A parameter for monitoring
periodontal conditions in clinical practice. Journal of Clinical Periodontology, 21(6), 402-
408.
-Karlsson, K., Derks, J., Hakansson, J., Wennström, J. L., Petzold, M., & Berglundh, T. (2019).
Interventions for peri-implantitis and their effects on further bone loss: A retrospective
analysis of a registry-based cohort. Journal of Clinical Periodontology, 46(8), 872-879.
doi:10.1111/jcpe.13129
-Karoussis, I. K., Salvi, G. E., Heitz-Mayfield, L. J., Brägger, U., Hämmerle, C. H., & Lang, N. P.
(2003). Long-term implant prognosis in patients with and without a history of chronic
periodontitis: a 10-year prospective cohort study of the ITI Dental Implant System. Clinical
Oral Implants Research, 14(3), 329-339.
-Kordbacheh Changi, K., Finkelstein, J., & Papapanou, P. N. (2019). Peri-implantitis prevalence,
incidence rate, and risk factors: A study of electronic health records at a U.S. dental
school. Clinical Oral Implants Research, 30(4), 306-314. doi:10.1111/clr.13416
-Lang, N. P., Adler, R., Joss, A., & Nyman, S. (1990). Absence of bleeding on probing. An indicator
of periodontal stability. Journal of Clinical Periodontology, 17(10), 714-721.
-Lang, N. P., Suvan, J. E., & Tonetti, M. S. (2015). Risk factor assessment tools for the prevention of
periodontitis progression a systematic review. Journal of Clinical Periodontology, 42 Suppl
16, S59-70. doi:10.1111/jcpe.12350
-Lang, N. P., & Tonetti, M. S. (2003). Periodontal risk assessment (PRA) for patients in supportive
periodontal therapy (SPT). Oral Health Prev Dent, 1(1), 7-16.
Löe, H., & Silness, J. (1963). Periodontal Disease in Pregnancy. I. Prevalence and Severity. Acta
Odontologica Scandinavica, 21, 533-551.
-Luterbacher, S., Mayfield, L., Brägger, U., & Lang, N. P. (2000). Diagnostic characteristics of
clinical and microbiological tests for monitoring periodontal and peri-implant mucosal
tissue conditions during supportive periodontal therapy (SPT). Clinical Oral Implants
Research, 11(6), 521-529.
Accepted Article
This article is protected by copyright. All rights reserved
-Matuliene, G., Pjetursson, B. E., Salvi, G. E., Schmidlin, K., Brägger, U., Zwahlen, M., & Lang, N. P.
(2008). Influence of residual pockets on progression of periodontitis and tooth loss:
results after 11 years of maintenance. Journal of Clinical Periodontology, 35(8), 685-695.
doi:10.1111/j.1600-051X.2008.01245.x
-Mombelli, A., Marxer, M., Gaberthuel, T., Grunder, U., & Lang, N. P. (1995). The microbiota of
osseointegrated implants in patients with a history of periodontal disease. Journal of
Clinical Periodontology, 22(2), 124-130.
-Mombelli, A., van Oosten, M. A., Schürch, E., Jr., & Lang, N. P. (1987). The microbiota associated
with successful or failing osseointegrated titanium implants. Oral Microbiol Immunol,
2(4), 145-151.
-Monje, A., Aranda, L., Diaz, K. T., Alarcon, M. A., Bagramian, R. A., Wang, H. L., & Catena, A.
(2016). Impact of Maintenance Therapy for the Prevention of Peri-implant Diseases: A
Systematic Review and Meta-analysis. Journal of Dental Research, 95(4), 372-379.
doi:10.1177/0022034515622432
-Mühlemann, H. R. (1973). [Experimental models in periodontic research]. Deutsche Zahnarztliche
Zeitschrift, 28(2), 106-112.
-Papapanou, P. N., Wennström, J. L., & Gröndahl, K. (1988). Periodontal status in relation to age
and tooth type. A cross-sectional radiographic study. Journal of Clinical Periodontology,
15(7), 469-478.
-Pjetursson, B. E., Helbling, C., Weber, H. P., Matuliene, G., Salvi, G. E., Brägger, U., Lang, N. P.
(2012). Peri-implantitis susceptibility as it relates to periodontal therapy and supportive
care. Clinical Oral Implants Research, 23(7), 888-894.
doi:http://dx.doi.org/10.1111/j.1600-0501.2012.02474.x
-Roccuzzo, M., Bonino, F., Aglietta, M., & Dalmasso, P. (2012). Ten-year results of a three arms
prospective cohort study on implants in periodontally compromised patients. Part 2:
clinical results. Clinical Oral Implants Research, 23(4), 389-395. doi:10.1111/j.1600-
0501.2011.02309.x
-Roccuzzo, M., De Angelis, N., Bonino, L., & Aglietta, M. (2010). Ten-year results of a three-arm
prospective cohort study on implants in periodontally compromised patients. Part 1:
Accepted Article
This article is protected by copyright. All rights reserved
implant loss and radiographic bone loss. Clinical Oral Implants Research, 21(5), 490-496.
doi:CLR1886 [pii]10.1111/j.1600-0501.2009.01886.x
-Schwarz, F., Derks, J., Monje, A., & Wang, H. L. (2018). Peri-implantitis. Journal of Periodontology,
89 Suppl 1, S267-S290. doi:10.1002/JPER.16-0350
-Serino, G., & Ström, C. (2009). Peri-implantitis in partially edentulous patients: association with
inadequate plaque control. Clinical Oral Implants Research, 20(2), 169-174.
doi:10.1111/j.1600-0501.2008.01627.x
-Serino, G., & Turri, A. (2011). Outcome of surgical treatment of peri-implantitis: results from a 2-
year prospective clinical study in humans. Clinical Oral Implants Research, 22(11), 1214-
1220. doi:http://dx.doi.org/10.1111/j.1600-0501.2010.02098.x
-Tonetti, M. S., Greenwell, H., & Kornman, K. S. (2018). Staging and grading of periodontitis:
Framework and proposal of a new classification and case definition. J Periodontol, 89
Suppl 1, S159-S172. doi:10.1002/JPER.18-0006
Source du document : https://onlinelibrary.wiley.com/doi/pdf/10.1111/clr.13585?fbclid=IwAR1_uouAuZPBACtLt2EnuamC-U4-ga53t6Sg5jS1A3_enJGf8IiNU8XN0os
Implant Disease Risk Assessment IDRA – a tool for preventing peri-implant
disease
Auteurs : Lisa J. A. Heitz-Mayfield, Fritz Heitz, Niklaus P. Lang
University of Western Australia, Australia
University of Berne, Switzerland